Costa M. S., Ferreira M. M. C., "Estudo Teórico de Alguns Intermediários Radicalares e Neutros da Artemisinina" ["Theoretical Study of Some Radical and Neutral Artemisinin Intermediates"]. Caxambu, MG, 23-26/11/2003: 12° Simpósio Brasileiro de Química Teórica (XII SBQT) [12th Brazilian Symposium of Theoretical Chemistry], Livro de Resumos [Book of Abstracts], (2003) P260. Poster P260.
|
|
ESTUDO
TEÓRICO DE ALGUNS INTERMEDIÁRIOS
RADICALARES
E NEUTROS DA ARTEMISININA
Mírian
S. Costa (PG), Márcia M. C. Ferreira (PQ),
marcia@iqm.unicamp.br
Instituto
de Química / Universidade Estadual de Campinas - Unicamp / Campinas
SP / CEP:
13083-970
Palavras-chave: artemisinina, radicais, cálculos ab initio.
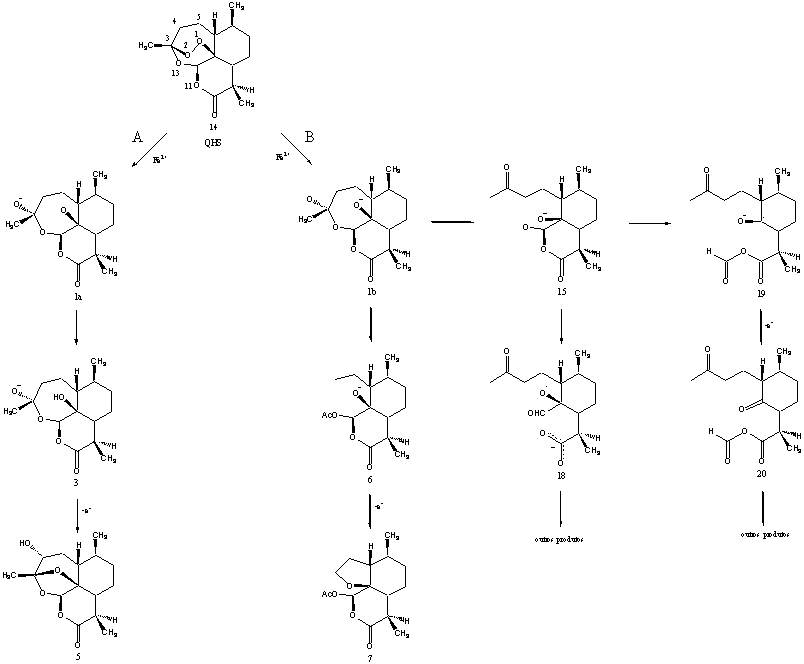
O mecanismo de ação
de qualquer fármaco é
de suma importância para
o
desenvolvimento do
mesmo. O objetivo deste trabalho
foi estudar teoricamente alguns dos
intermediários de
reação da artemisinina, a qual possui atividade antimalárica
contra Plasmodium
falciparum.
Existem vários estudos experimentais sobre o mecanismo de
ação desta droga como:
(1) reações
de alquilação de proteínas specíficas do parasita,
(2) hidroxilação de biomoléculas por
radicais de oxigênio
derivados do hidroperóxido (formado pela abertura
do anel da artemisinina),
(3) alquilação
do heme (ou modelos de heme)
dentre outros. A artmisinina possui uma função
endoperóxido a qual
tem se mostrado essencial para a atividade antimalárica, onde
esta droga age
principalmente dentro
dos eritrócitos. Empregou-se o método
ab initio HF/6-31G** para a
otimização
das geometrias da artemisinina e de
alguns prováveis intermediários de ação
desta
droga e para o cálculo
das energias eletrônicas e livres destes intermediários
em questão. Dentre
os radicais calculados ao
longo do caminho de decomposição redutiva da artemisinina,
a diferença
de energia livre entre o
radical centrado no átomo de oxigênio 1a/1b (Figura) e o radical
secundário
3 é de
-12,06 kcal mol-1 e de -15,92
kcal mol-1 entre o radical primário
6. Isto indica que a cisão
homolítica da ligação
C3-C4,
isto é, a passagem de 1b para 6,
é preferencial do ponto de vista
energético.
Observou-se, através da análise das
energias eletrônicas e energias livres, que a
formação do
intermediário 20 é favoravel energeticamente,
além de ser o mais estável. A análise
das energias
eletrônicas mostra que há a liberação
de -72,18 kcal mol-1
para a formação deste
intermediário,
enquanto que a análise da Energia Livre de Gibbs
fornece DG
Total no valor de
-82,24 kcal mol-1
para a formação do mesmo intermediário.
Através da análise de ambas
as
energias (eletrônicas
e livres), chega-se à mesma conclusão de
que a rota para a formação do
intermediário
de reação 20 é preferencial.
Figura: Mecanismos
de ação da artemisinina propostas por Posner1
(rota A), por Jefford2 (rota
B,
levando ao intermediário
7) e por Wu3 (rota B, levando aos intermediários
18 e 20).
1Posner, G. H.;
Cummings, J. N.; Ploypradith, P.; Oh, C. H., J. Am. Chem. Soc.,
117, 5885, 1995. /
2Jefford,
C. W.; Vicente, M. G. H.; Jacquier, Y.; Favarger, F.;
Mareda, J.; Millasson-Schmidt, P.;
Brunner, G.; Burger,
U., Helv. Chim. Acta, 79, 1475, 1996. / 3Wu,
W.-M.; Wu, Y.-L.; Yao, Z.-J.;
Zhou, C.-M.; Li, Y.; Shan,
F., J. Am. Chem. Soc., 120, 3316, 1998.
|
|
THEORETICAL
STUDY OF SOME RADICAL AND NEUTRAL
ARTEMINISIN
INTERMEDIARIES
Mírian
S. Costa (PG), Márcia M. C. Ferreira (PQ),
marcia@iqm.unicamp.br
Instituto
de Química / Universidade Estadual de Campinas - Unicamp / Campinas
SP / CEP:
13083-970
Key-words: artemisinin, radicals, ab initio calculations.
Knowing the mechanism of activity of a drug
is of great importance for its design. The
purpose of this work
is to study by theoretical means some intermediaries
in reaction mechanism
of artemisinin acitivity.
Artemisinin expresses antimalarial activity against Plasmodium
falciparum.
There are various experimental
studies about the mechanism of action of this drug:
(1) alquilation
reactions on
specific parasite proteins, (2) hydroxylation
of biomolecules by oxygen radicals
derived from hydroxyperoxyde
(formed by a ring opening in artemisinin), (3) alquilation of the
heme
(or of heme models), among
others. Artemisinin possesses an endoperoxyde group which has been
shown to be essential
for its antimalarial activity inside erythrocytes. Ab initio
method HF/6-31G**
was used for geometry optimization
for artemisinin and some of its probable intermediaries to
obtain
electronic and free energies
of these intermediaries. When studying the radicals involved in pathway
of the reduction decomposition
of artemisinin, the energy difference between
the oxygen-centred
and the secondary
radical 3 was -12,06 kcal mol-1,
and between the former and the primary
radicl 6 the
energy was -15,92 kcal mol-1.
This means that the cleavage of the bond C3-C4
that
occurs in transition
from 1b to 6, is energetically
preferred. It has been observed
also that,
intermediary 20 is
the most stable, and its formation is
energetically favoured. The analysis of
electronic energies
has shown that there is an energy liberation of
-72,18 kcal mol-1 in
formation
of this intermediary.
The analysis of the total free Gibbs energy
DG
gives -82,24 kcal mol-1
for
formation of
20. The both analyses lead to
the conclusion that the route which
includes the
formation of 20,
is the preferred one.
Figure: Mechanisms
of artemisinin activity as proposed by Posner1
(route A), Jefford2 (route
B,
resulting in intermediary
7) e Wu3 (route B, resulting in intermediaries
18 and20).
1Posner, G. H.;
Cummings, J. N.; Ploypradith, P.; Oh, C. H., J. Am. Chem. Soc.,
117, 5885, 1995. /
2Jefford,
C. W.; Vicente, M. G. H.; Jacquier, Y.; Favarger, F.;
Mareda, J.; Millasson-Schmidt, P.;
Brunner, G.; Burger,
U., Helv. Chim. Acta, 79, 1475, 1996. / 3Wu,
W.-M.; Wu, Y.-L.; Yao, Z.-J.;
Zhou, C.-M.; Li, Y.; Shan,
F., J. Am. Chem. Soc., 120, 3316, 1998.