Costa M. S., Ferreira M. M. C., "Estudo teórico da interação existente entre o heme e a artemisinina" ["Theoretical study of interactions between heme and artemisinin"]. São Pedro, SP, 20-23/11/2005: XIII Simpósio Brasileiro de Química Teórica (XIII SBQT) [13th Brazilian Symposium of Theoretical Chemistry], Livro de Resumos [Book of Abstracts], 148. Poster 148.
148
ESTUDO TEÓRICO
DA INTERAÇÃO EXISTENTE ENTRE O HEME E A ARTEMISININA
Mírian
S. Costa (PG), Márcia M. C. Ferreira (PQ)*
*marcia@iqm.unicamp.br
Instituto de Química / Universidade Estadual de Campinas - Unicamp / Campinas – SP / CEP: 13083-970
Palavras Chave: artemisinina,
heme, cálculo semi-empírico.
No desenvolvimento e descobrimento de
uma droga é de suma
importância conhecer seu
mecanismo de ação,
pois auxilia no desenvolvimento de novas drogas mais efetivas. Normalmente
a droga
tem seu efeito mediado por
um alvo específico, um receptor. Caso a
estrutura do complexo droga-receptor
seja conhecida,
as interações entre a droga,
que no estudo em questão é a artemisinina,
e o receptor
(heme) podem ser investigadas
com mais detalhes. O objetivo deste trabalho
foi investigar teoricamente a
interação
existente entre a artemisinina (QHS) e
o heme, estudando a barreira de rotação
entre ambos.
Durante esta etapa utilizaram-se
os programas SPARTAN e TITAN, com o
método semi-empírico PM3.
Existem vários
estudos a respeito da interação
heme-artemisinina. Tonmunphean e colaboradores1,2
estudaram a interação
entre a artemisinina e 29 derivados e o heme, e
entre a artemisinina e cinco tipos
diferentes de estruturas
do heme. Cheng e colaboradores3
analisaram a interação existente entre o heme e
23 análogos
da artemisinina. Pinheiro e colaboradores4,
pertencentes ao nosso grupo de
pesquisa,
analisaram a interação
existente entre a artemisinina e quatro
análogos da mesma com o heme. Para os
cálculos à
vácuo, observou-se que a região de menor energia entre
o heme e a artemisinina compreende ao
ângulos de
rotação entre 20,00 e 80,59º.
Foi feito o refinamento da barreira rotacional
neste intervalo,
obtendo a menor
energia (DHf
= -100,86 kcal mol-1)
existente no complexo QHS-heme corresponde
ao
ângulo de
rotação 51,90º. Na
configuração de menor energia entre
o heme e a artemisinina foram
encontradas 22 interações
C-H...p
que estão de acordo com os valores permitidos de 2,0 Å a 3,0
Å (erros de
± 0.1 Å).
Analisando o potencial eletrostático da conformação
mais estável do complexo QHS-heme, tem-se
uma idéia
da distribuição das regiões
polares (em vermelho), a qual encontra-se
ao redor da ligação
peróxido.
As partes polares e hidrofóbicas (grupos metil) do
fármaco estão respetivamente direcionadas
para as partes
polares (área central Fe-N)
e hidrofóbicas (grupos metil
e etil) do receptor heme.
Basicamente somente o anel
da porfirina e quatro átomos da artemisinina foram fixados.
Devido os grupos
propionatos do heme estarem
fixos durante os cálculos em questão, não
se observaram interações efetivas
entre os átomos de
oxigênio destes grupos com os átomos de hidrogênio da
artemisinina. A conformação de
menor energia
do complexo solvatado heme-QHS
possui seis ligações hidrogênio
com os grupos
propionatos. Estas
ligações hidrogênio conferem estabilidade
ao complexo, gerando uma estrutura que
possui menor calor de formação
(DHf = -700,168
kcal mol-1)
que aquela realizada com cálculos à vácuo.

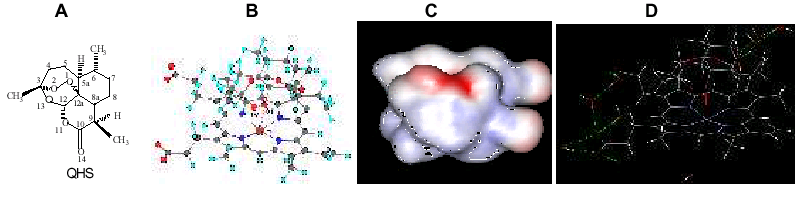
Figura: A: Estrutura
da artemisinina. B: Conformação de menor energia entre
artemisinina-heme, onde os
átomos do
ângulo diedro estâo destacados. C:
Potencial eletrostático para a conformação
de menor
energia. D:
Conformação de menor energia para o complexo heme-QHS solvatado,
onde as ligações de
hidrogênio estão
em verde.
1Tonmunphean,
S.; Parasuk, V.; Kokpol, S. J.
Mol. Mod., 7, 26-33, 2001.
/ 2Tonmunphean, S.;
Parasuk, V.; Kokpol,
S. Quant. Struct. Act. Relat., 19, 475-483, 2000. / 3Cheng,
F.; Shen, J.; Luo, X.; Zhu,
R.; Gu, J.; Ji, R.;
Jiang, H.; Chen, K. Bioorg. Med. Chem., 10, 2883-2891, 2002.
/ 4Pinheiro, J. C.; Kiralj,
R.; Ferreira, M. M. C. QSAR
Comb. Sci., 22, 830-842, 2003.
148
THEORETICAL STUDY OF
INTERACTONS BETWEEN HEME AND ARTEMISININ
Mírian
S. Costa (PG), Márcia M. C. Ferreira (PQ)*
*marcia@iqm.unicamp.br
Instituto de Química / Universidade Estadual de Campinas - Unicamp / Campinas – SP / CEP: 13083-970
Key Words: artemisinin,
heme, semi-empirical calculations.
The mechanism of a drug action is much important in
drug discovery and development because this
knowledge can help
in development of more effective drugs.
Usually a drug action is mediated by some
specific target, a receptor.
When the structure of a drug-receptor complex is known, the interactions
between
the drug (in this case artemisinin)
and the receptor can be investigated with more details. The purpose
of this
work is to study interactions
between artemisinin (QHS) and heme theoretically, by investigating
the rotational
barrier between the two
molecules. During this phase of the research, programs
SPARTAN and TITAN were
used, applying
the semi-empirical method PM3. There
are various studies dealing with heme-artemisinin
interactions.
Tonmunphean and collaborator1,2
studied interactions between artemisinin
and 29 heme
derivatives, and also
between artemisinin and five different
heme structures. Cheng and collaborators3
analyzed the interactions
between heme and 23 artemisinin analogues. Pinheiro and collaborators4
from our
research group, analyzed
the interaction of artemisinin and its four analogues with heme.
For calculations in
vacuum, it was
observed that the region of the lower energy for heme-artemisinin
complex corresponded to
the angle of rotation
varying from 20.00 to 80.59º. The
refinement of the rotational barrier calculations was
made for this interval,
by which the minium energy (DHf
= -100.86 kcal mol-1)
was obtained for the QHS-
artemisinin complex, and
the corresponding rotational angle was 51.90º. There were
22 C-H...p
interactions
observed at allowed distances
from 2.0 to 3.0 Å (errors of
± 0.1 Å) in the minimum energy conformer of the
heme-artemisinine complex.
When analyzing the electrostatic potential of this most stable coplex conformation,
one can have an idea of
the distribution of polar regions (in red), which
are around the peroxyde bond. The
polar and hydrophobic (methyl
groups) parts of the drug are directioned towards the respective
polar (central
Fe-N area) and hydrophobic
(methyl and ethyl groups) parts of the heme receptor.
Only the porphyrin ring
and four artemisinin
atoms were fixed in calculations. Since the propionate groups
stood mainly fixed during
the calculations,
there were not observed interactions between the
oxygen atoms from these groups and
artemisinin hydrogen atoms.
The minimum energy conformation of the solvated
QHS-heme complex has
six hydrogen
bonds involving the propionate groups. These
hydrogen bonds contribute to the complex
stability, by which the
structure has even lower heat of formation (DHf
= -700,168 kcal mol-1)
than it had
in calculations in vacuum.

Figure: A: The structure
of artemisinine. B: The minimum energy stucture of artemisinin-heme
complex, with
marked atoms to define the
dihedral angle. C: Electrostatic potencial
for the minimum energy conformation.
D: The minimum energy
conformation of solvated QHS-heme complex, with hidrogen bonds marked green.
1Tonmunphean,
S.; Parasuk, V.; Kokpol, S. J.
Mol. Mod., 7, 26-33, 2001.
/ 2Tonmunphean, S.;
Parasuk, V.; Kokpol,
S. Quant. Struct. Act. Relat., 19, 475-483, 2000. /
3Cheng, F.; Shen, J.; Luo,
X.; Zhu,
R.; Gu, J.; Ji, R.;
Jiang, H.; Chen, K. Bioorg. Med. Chem.,
10, 2883-2891, 2002. / 4Pinheiro,
J. C.; Kiralj,
R.; Ferreira, M. M. C. QSAR
Comb. Sci., 22, 830-842, 2003.