do sistema nas simulações de DM após estabilização.
Barbosa E. G., Pasqualoto K. F. M., Ferreira E. I., Ferreira M. M. C., "Aplicação de docking e dinâmica molecular para elucidar o modo de interação de um conjunto de fentotiazínicos derivados de arilaquilamônio com a tripanotiona redutase do Trypanosoma cruzi" ["Docking and molecular dynamics application in elucidation of the interaction between phenothiazinic derivatives of arylalkylammonium and tripanothione reductase of Trypanosoma cruzi"]. Fortaleza, CE, 30/05-02/06/2009: 32a Reunião Anual da Sociedade Brasileira de Química - Para Uma Potência Emergente [32nd Annual Meeting of the Brazilian Chemical Society - For An Emergent Potency], CDROM online, (2009) T0457-1. Poster MD-022.
Sociedade Brasileira de Química (SBQ)
Aplicação de
docking
e dinâmica molecular para elucidar o modo de
interação
de um conjunto de fenotiazínicos derivados de arilaquilamônio
com a tripanotiona redutase
do Trypanosoma cruzi
Euzébio Guimarães
Barbosa1 (PG), Kerly Fernanda Mesquita
Paqualoto2 (PQ),* Elizabeth Igne
Ferreira2
(PQ), Márcia Miguel Castro Ferreira1
(PQ) *kerly@usp.br
1LQTA- IQ – UNICAMP; 2LAPEN – FCF - USP
Palavras Chave: Doença de Chagas, Tripanotiona Redutase, Docking, Dinâmica Molecular.
Introdução
A tripanotiona redutase
(TR), uma flavoenzima NADPH dependente, é a enzima principal e essencial
do sistema de defesa antioxidante de tripanossomatídeos, que são
protozoários responsáveis por doenças parasitárias,
como a doença de Chagas ou Tripanossomíase Americana (Trypanosoma
cruzi), por exemplo.1 A estrutura tridimensional
da TR do T. cruzi em presença de inibidores (compostos tricíclicos
derivados de acridina) foi isolada por Saravanamuthu e colaboradores (2004)
utilizando cristalografia de raios X (código PDB 1gxf).2
A disponibilidade de tal estrutura, associada às diferenças
de especificidade do substrato encontradas entre TR e sua homóloga
presente em mamíferos, a glutationa redutase (GT), são fatores
determinantes à escolha da TR como alvo para o planejamento de novos
fármacos contra tripanossomíases.3
Neste estudo, aplicaram-se metodologias de docking e de dinâmica
molecular para elucidar o modo de interação de tricíclicos
fenotiazínicos derivados de arilaquilamônio (fármaco
protótipo clorpromazina) com a TR do T. cruzi. O conjunto
de compostos (N = 40) foi selecionado das refs. [4-7].
Resultados e Discussão
O estudo de docking
(AutoDock) do ligante mais ativo, OFK006 (Ki
= 0,12 mM),4
no sítio de interação da TR do T. cruzi (1gxf)
forneceu 4 conformações promissoras e distintas, que foram
empregadas como geometria inicial para desenvolver simulações
de DM de 1 ns (GROMACS) (1ª SDM). Após a primeira simulação
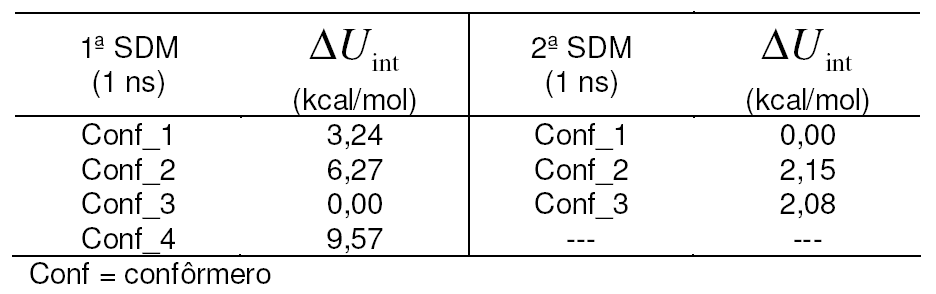
de DM, a conformação energeticamente mais favorável
(Conf_3 Tabela 1) apresentou tendência marcante de projeção
do anel fenotiazínico no sítio ativo e formação
de interações
p-stacking
com os resíduos de aminoácido (aa) Trp22, Phe115 e Tyr111.
A disposição espacial do sítio ativo foi aproveitada
para o re-docking, que indicou 3 novas conformações.
Estas foram submetidas à segunda simulação de DM de
1 ns (2ª SDM). Duas das conformações convergiram para
condições semelhantes de energia de interação,
enquanto uma delas (Conf_1 Tabela 1) convergiu para o modo de interação
postulado por Saravanamuthu e colaboradores (2004). Na Fig.1 está
representado o modo de interação da Conf_1 com os aa do sítio
ativo da TR do T.cruzi envolvidos no processo. Verifica-se que ampla
e bem localizada rede de interações p-stacking
é estabelecida com a característica dobra do anel fenotiazínico.
A porção do nitrogênio quaternário, quando separada
do núcleo tricíclico por três grupos metilênicos,
é bastante disponível à aproximação
do resíduo de aa Glu19. Tal fato explicaria a diminuição
de atividade anti-T. cruzi de análogos com maior ou menor
distância entre o centro positivamente carregado e o núcleo
tricíclico.
Tabela 1. Diferenças
de energia de interação entre o ligante e o restante
do sistema nas simulações
de DM após estabilização.

Figura 1. Modo de interação postulado para o Conf_1 do ligante mais ativo, proveniente da 2ª SDM, no sítio ativo da TR do T. cruzi.
Conclusões
A aplicação
conjunta de metodologias de docking e de DM permitiu a elucidação
dos tipos de interações envolvidas entre os fenotiazínicos
derivados de arilalquilamônio e a TR do T. cruzi. Novos inibidores
da TR do T. cruzi podem ser planejados, considerando-se os resultados
obtidos neste estudo preliminar.
Agradecimentos
CAPES e FAPESP.
____________________________
1Duschak, V.G.;
Couto, A.S. Recent Patents Anti-Infec. Drug Disc. 2007, 2,
19.
2Saravanamuthu,
A.; Vickers, T.J.; Bond, C.S. et. al. J. Biol. Chem. 2004,
279,
29493.
3Augustins, K.;
Amssoms, K.; Yamani, A. et al. Curr. Pharm. Des. 2001, 7,
1117.
4Khan, M.O.F.;
Austin, S.E.; Chan, C. et al. J. Med. Chem. 2000, 43,
3148.
5Parveen, S.,
Khan, M.O.F., Austin, S.E. et al. K.T. J. Med. Chem., 2005,
48,
8087.
6Chan, C.; Yin,
H.; Garforth, J. et al. J. Med. Chem., 1998, 41, 148.
7Garforth J.;
Yin, H.; McKie, J. H. et al. J. Enzyme Inhib. Med. Chem., 1997,
12,
161.
32a Reunião Anual
da Sociedade Brasileira de Química
English
Sociedade Brasileira de Química (SBQ)
Docking and molecular dynamics
application in elucidation of the interaction between phenothiazinic derivatives
of arylalkylammonium and tripanothione reductase of Trypanosoma cruzi
Euzébio Guimarães
Barbosa1 (PG), Kerly Fernanda Mesquita
Paqualoto2 (PQ),* Elizabeth Igne
Ferreira2
(PQ), Márcia Miguel Castro Ferreira1
(PQ) *kerly@usp.br
1LQTA- IQ – UNICAMP; 2LAPEN – FCF - USP
Key-words: Chagas Disease, Tripanothione Redutase, Docking, Molecular Dynamics.
Introduction
Tripanothione reductase
(TR), is a NADPH-dependent flavoenzyme, the main enzyme of the antioxidant
defense system of
tripanossomatides, the protozoans
responsibles for parasitic diseases such as Chagas disease or American
Tripanossomiase (Trypanosoma cruzi).1
Three-dimensional structure of TR from T. cruzi with inhibitors
(tricyclyc derivatives of acridine) was determined by Saravanamuthu and
colaborators (2004) by means of X-ray crystallography (código PDB
code 1gxf).2 The avalability of this structure,
and the similarities between TR and its homologues in mammals in terms
of substrate specificity were the reasons to choose TR as the target in
design of new drugs against tripanossomiases.3
In this study, docking and molecular dynamics methodologies were applied
with the purpose to elucidate the mode of interaction between tricyclyc
phenothiazinic derivatives of arylalquilammonium (drug chlorpromazine prototype)
and TR from T. cruzi. A set of compounds (N = 40) was selected from
refs. [4-7].
Results e Discussion
Docking study of the most
active ligand OFK006 (Ki = 0.12
mM)4
at the active site of TR fromuzi (1gxf) by means of AutoDock has
resulted in 4 distinct and potent conformations, which were used for initial
geometry in MD simulations of 1 ns (1st
MD) by GROMACS. After the first MD simulation, the most energetically favorable
conformation (Conf_3 Table 1) exibited suitable complementarity
of the phenothiazinic ring with the active site via p-stacking
interactions established with the amino-acid (aa) residues Trp22, Phe115
andTyr111. Spatial arrangement of the active site was used for re-docking
by which three new conformations were identified. These were submitted
to the second MD simulation of 1 ns (2nd
MD). Two of these conformations similarly converged in terms of interaction
energy, whilst the third conformation (Conf_1 Table 1) converged
into the mode of interaction as reported by Saravanamuthu and colaborators
(2004). Fig.1 shows the mode of interaction between Conf_1 with
aa of the active site of TR from T.cruzi. A net of well-established
p-stacking
interactions involving the phenothiazinic ring can be noticed. The quaternary
nitrogen is separated from the tricyclyc ring by three methylene groups,
what makes it rather exposed to the proximal aa residue Glu19. This may
explain why the anti-T. cruzi of the derivatives decreases when
the distance betwen the positively charged center and tricyclic nucleus
becomes shorter or longer.
Table 1. Energy differences
for interactions betwen the ligand and the
rest of the system in DM
simulations after stabilization.
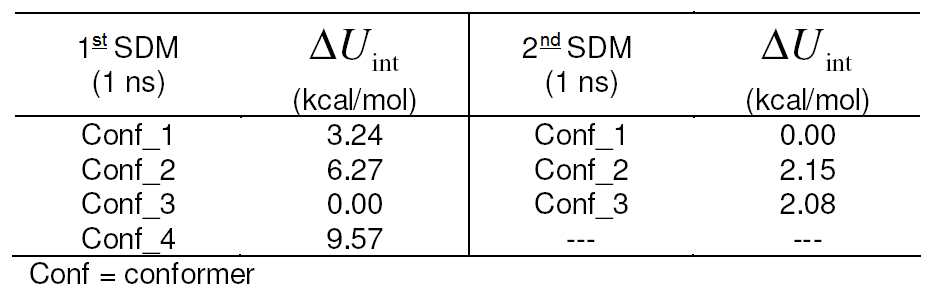
Figure 1. Mode of interaction for Conf_1 of the more active ligand at the active site of TR from T. cruzi, as obtained from 2nd SDM.
Conclusions
The joint application of
the docking and MD methodologies aided in having more insight on
types of intermolecular interactions between phenothiazinic derivatives
of arylalquilammonium and TR of T. cruzi. New inhibitors of TR from
T.
cruzi can be modeled according to the results of this preliminary study.
Acknowledgements
CAPES and FAPESP.
____________________________
1Duschak, V.G.;
Couto, A.S. Recent Patents Anti-Infec. Drug Disc. 2007, 2,
19.
2Saravanamuthu,
A.; Vickers, T.J.; Bond, C.S. et. al. J. Biol. Chem. 2004,
279,
29493.
3Augustins, K.;
Amssoms, K.; Yamani, A. et al. Curr. Pharm. Des. 2001, 7,
1117.
4Khan, M.O.F.;
Austin, S.E.; Chan, C. et al. J. Med. Chem. 2000, 43,
3148.
5Parveen, S.,
Khan, M.O.F., Austin, S.E. et al. K.T. J. Med. Chem., 2005,
48,
8087.
6Chan, C.; Yin,
H.; Garforth, J. et al. J. Med. Chem., 1998, 41, 148.
7Garforth J.;
Yin, H.; McKie, J. H. et al. J. Enzyme Inhib. Med. Chem., 1997,
12,
161.
32a Reunião Anual
da Sociedade Brasileira de Química