Martins J. P. A., Muniz Filho R. C. D., Pereira F. S., Ferreira M. M. C., "Investigação Teórica do Mecanismo de Abertura de Anéis Epoxídicos" ["Theoretical Investigation of the Mechanism of Epoxide Ring Opening"]. Poços de Caldas, MG, 18-21/11/2007: XIV Simpósio Brasileiro de Química Teórica [14th Brazilian Symposium of Theoretical Chemistry], Resumos [Abstracts], (2007) 322. Poster.
Sociedade Brasileira de Química
(SBQ)
Investigação Teórica do Mecanismo de Abertura de Anéis Epoxídicos
João Paulo Ataíde Martins (PG), Raimundo Clecio Dantas Muniz Filho (PG), Flávia da Silva Pereira (PG), Márcia Miguel Castro Ferreira (PQ)
Instituto de Química, Universidade
Estadual de Campinas, CEP 13083-970 Campinas - SP.
e-mail: marcia@iqm.unicamp.br
Palavras Chave: Epóxidos, DFT, Cargas Atômicas, IRC
Introdução
Epóxidos são
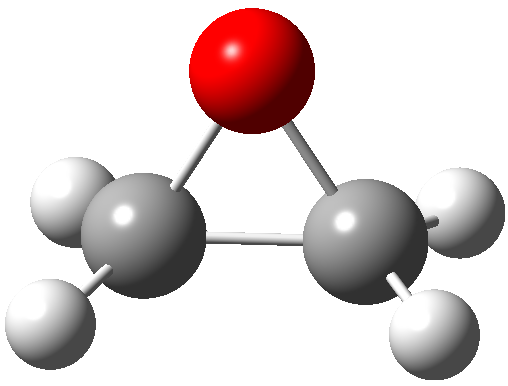
éteres cíclicos com anéis de três membros (Figura-1)
bastante conhecidos por serem importantes intermediários na síntese
orgânica1.
Figura-1. Estrutura molecular de um epóxido.
Em virtude da tensão
angular e da polaridade desta classe de moléculas, reações
que envolvem a abertura deste anel são suscetíveis a uma
grande variedade de ataques nucleofílicos.
Na Figura-2, apresentamos
uma provável rota de abertura do anel epoxídico, catalisada
por ácido, frente a um ataque de um nucleófilos.
Figura-2. Provável mecanismo de abertura do anel epoxídico.
A proposta deste trabalho
é investigar teoricamente o mecanismo de reação de
abertura do anel dos compostos C2H4O,
C2H3OCH3
e C2H2O(CH3)2,
catalisadas por ácidos e bases, analisando variáveis tais
como, cargas atômicas, potencial eletrostático e a energética
da reação.
Cálculos de otimização
de geometria e freqüência vibracional foram realizados usando
o método DFT/B3LYP e o conjunto de base 6-311G(d,p). Para um melhor
entendimento do mecanismo de reação, cálculos de IRC
estão sendo aplicados, iniciando a partir da estrutura otimizada
do estado de transição, e usando um passo de 0,100 (a.m.u)1/2.bohr.
Resultados e Discussão
Segundo a literatura2,
quando esta reação é catalisada por ácido,
o ataque do nucleófilo ocorre preferencialmente no carbono mais
substituído, já quando ela é catalisada por base,
este ataque ocorre preferencialmente no carbono menos substituído.
Analisando a Tabela-1, que se refere aos valores de cargas atômicas
de Mülliken para epóxidos catalisados em meio ácido
e básico, pode-se confirmar que quando a reação é
catalisada por ácido, o ataque ocorre no carbono mais substituído
(C1).
Tabela-1. Valores de cargas
atômicas de Mülliken para epóxidos catalisados por ácido
e meio básico.
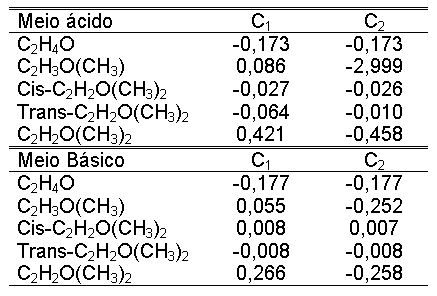
Já quando a reação
é catalisada por base, os resultados indicam que o ataque nucleofílico
deve ocorrer preferencialmente no carbono mais substituído (C1),
contradizendo assim a literatura.
Cálculos do potencial
eletrostático estão sendo feitos no sentido de reforçar
os resultados obtidos para a reação catalisada por ácido,
e verificar se são capazes de explicar a reação catalisada
por base. O mapeamento da superfície de energia potencial, por cálculos
de IRC, está sendo realizado, a fim de se obter detalhes energéticos
destas reações.
Conclusões
Modelos teóricos
de estrutura eletrônica se mostraram importantes ferramentas no estudo
da abertura de aneis epoxídicos, pois, através destes é
possível entender a reatividade química e a regiosseletividade
de moléculas. No entanto, modelos de carga atômicas não
se mostraram eficientes para explicar a reatividade química dos
epóxidos frente a um ataque nucleofílico em meio básico.
Agradecimentos
Os autores agradecem ao
CNPq aos recursos disponibilizados à pesquisa.
____________________________
1 Antoniotti,
S.; Antonczak, S.; Golebiowski, J. Theoretical Chemistry Accounts,
2004,
112,
290.
2 Solomons, T.
W. G.; Fryhle, C. B.; Química Orgânica, 7a
ed., LTC - Livros Técnicos e Científicos Editora S. A.: Rio
de Janeiro, 2001.
322
English
Sociedade Brasileira de Química
(SBQ)
Theoretical Investigation of the Mechanism of Epoxide Ring Opening
João Paulo Ataíde Martins (PG), Raimundo Clecio Dantas Muniz Filho (PG), Flávia da Silva Pereira (PG), Márcia Miguel Castro Ferreira (PQ)
Instituto de Química, Universidade
Estadual de Campinas, CEP 13083-970 Campinas - SP.
e-mail: marcia@iqm.unicamp.br
Key Words: Epoxides, DFT, Atomic Charges, IRC
Introduction
Epoxides are cyclic ethers
with a three-membered ring (Figure-1), well-known after their importance
as intermediaries in organic synthesis1.
Figure-1. Molecular structure of an epoxide.
This class of molecules have
a characteristic angula tension and polarity, what makes such rings susceptible
to a nucleophilic attack during the reaction of the ring opening.
Figure-2 shows a probable
route of the epoxide ring opening, catalized by an acid before the nucleophilic
attack.
Figure-2. Probable mechanism of the epoxide ring opening.
The aim of this work is to
carry out theoretical study about the mechanism of the epoxide ring opening
in compounds C2H4O,
C2H3OCH3
and C2H2O(CH3)2,
with acidic and basic catalysis, and analyzing calculated variables such
as atomic charges, electrostatic potential and reaction energetics.
Geometry optimization and
vibrational frequency calculations were performed by the method DFT/B3LYP
and basis set 6-311G(d,p). Calculations IRC are also in progress, with
the aim to get more insight into the reaction mechanism. These calculations
start with the optimized structures of transitional states, with steps
of 0.100 (a.m.u)1/2.bohr.
Results and Discussion
According to the literature2,
the nucleophilic attack in an acid-catalyzed reaction occurs predominantly
at the most substituted carbon, whilst the reaction at the least substituted
carbon occurs mostly in base-catalyzed reactions. When analyzing Table-1
with the values of Mulliken partial atomic charges for epoxides in acidic
and basic media, one can see that nucleophils attack the most substistuted
carbon (C1) during an acid-catalyzed reaction.
Table-1. Mulliken atomic
charges for epoxides catalyzed in acidic and basic media.
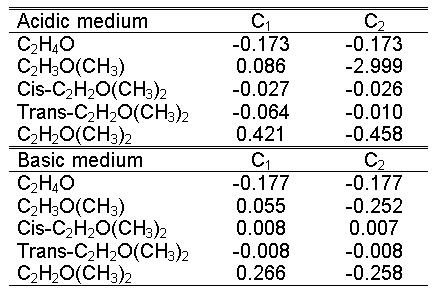
According to the results
for base-catalyzed reactions, a nucleophilic attack occurs predominantly
at the most substituted carbon (C1), what
is contrary to the literature.
Electrostatic potential
calculations are being made to support the obtained results for acid-catalyzed
reactions, and also to verify are these calculations useful for base-catalyzed
reaction mechanisms. Mapping of the IRC potential energy surface is in
progress, in order to obtain more details about the energetics of the studied
reactions.
Conclusions
The thoretical models of
electronic structure have been shown important means in study of the epoxide
ring opening, capable to explain the chemical reactivity and regioselectivity
involving the studied molecules. However, atomic charge models have not
been shown efficient in explaining the chemical reactivity of epoxides
relative to nucleophilic attack in basic media.
Acknowledgments
The authors acknowledge
CNPq for financial resources for this research.
____________________________
1 Antoniotti,
S.; Antonczak, S.; Golebiowski, J. Theoretical Chemistry Accounts,
2004,
112,
290.
2 Solomons, T.
W. G.; Fryhle, C. B.; Química Orgânica, 7a
ed., LTC - Livros Técnicos e Científicos Editora S. A.: Rio
de Janeiro, 2001.
322