Souza S. A. A., Muniz Filho R. C. D., Ferreira, M. M. C., "Energética envolvida no rearranjo intramolecular indólico na biossíntese da violaceina: Um estudo teórico" ["Energy of indolic intramolecular rearrangement in the biosynthesis of violacein: A theoretical study"]. Poços de Caldas, SP, 18-21/10/2009: XV Simpósio Brasileiro de Química Teórica [15th Brazilian Symposium of Theoretical Chemistry], Resumos [Abstracts] (2009) 92. Poster.
XV Simpósio Brasileiro de Química Teórica
A-I
Energética Envolvida no Rearranjo Intramolecular Indólico na Biossíntese da Violaceína: Um Estudo Teórico
Samuel Anderson Alves de Sousa (PG), Raimundo Clécio Dantas Muniz Filho (PG) e Márcia Miguel Castro Ferreira (PQ)
Instituto de Química,
Universidade
Estadual de Campinas, CEP 13083-970 Campinas - SP.
e-mail: marcia@iqm.unicamp.br
Introdução
e objetivos
A violaceína
é um pigmento azul isolado de diversas bactérias
incluindo a Chromobacterium violaceum,
uma bactéria saprofíta, Gram-negativa comumente
encontrada em solos e águas de regiões tropicais e
subtropicais do planeta. Esse pigmento exibe atividade
antibiótica contra microorganismos causadores da tuberculose, da
doença de chagas e da leishmaniose, além de efeitos
citotóxicos contra células tumorais [1]. O caminho
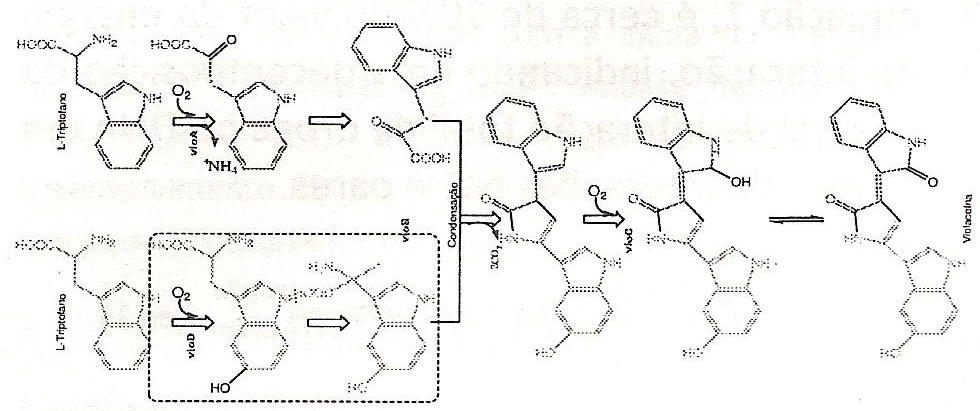
biossintético de produção da violaceína
(Figura 1) inclui uma fusão descarboxilativa de duas unidades de
triptofano. Entretanto, uma dessas moléculas sofre um rearranjo
intramolecular não usual, conhecido como 1,2 shift do anel
indólico [2].
Figura 1. Rota biossintética
de produção da violaceína.
Esse rearranjo consiste na movimentação de um substituinte para um átomo vizinho na mesma molécula, através de um intermediário reativo (carbocátion, carbânion ou radical livre). A proposta desse trabalho consiste em investigar teoreticamente a energética desse mecanismo permitindo um melhor entendimento desta reação, uma vez que tal estudo ainda não foi reportado na literatura.
Métodos e
resultados
Cálculos de
otimização de geometria e frequência vibracional
foram realizados usando o método DFT/B3LYP e conjunto de base
6-31G(d,p).
De maneira geral, os cálculos mostraram que o rearranjo
intramolecular citado apresenta uma pequena variação de
energia livre (1,96 kcal/mol), não fornecendo conclusões
a cerca de espontaneidade do processo, tendo em vista sua magnitude em
relação à energia térmica.
Momen & Hoshino [2] relatarm a quebra da ligação C-C
entre o anel indólico (R)
e a cadeia lateral (F) do
triptofano (vide Figura 2 (2A)) como passo inicial para o rearranjo
molecular. Para se conhecer a maneira mais provável de quebra
dessa ligação, computaram-se as energias dos pare (R+,F-) e (R-,F+) apresentadas na Tabela 1.
Figura 2. Rearranjo 1,2 shift do
anel indólico.
Conforme pode ser
observado nessa Tabela, a quebra citada é mais favorável
quando o grupo indólico (R)
ganha um elétron da cadeia lateral (F). A estabilização da
carga positiva resultante em F
sugere a formação de um rearranjo no intuito de gerar um
carbocátion mais estável que, posteriormente,
sofrerá um ataque consertado de R-, resultando na espécie 2B.
Tabela 1. Valores de energia
calculados para as
espécies supostamente envolvidas no rearranjo.
__________________________________
Pares
Energia (Hartree)
__________________________________
R++
F-
-761,22
R-
+ F+-
-761,27
__________________________________
Conclusões
Os resultados obtidos
apontam caminhos para futuras investigações do rearranjo
acima citado. Diante disso, buscas de intermediários para a
reação entre as espécies mais estáveis,
mostradas acima, estão sendo realizadas.
Agradecimentos
Os autores agradecem ao
CNPq e CAPES pelos recursos disponibilizados à pesquisa.
92
English
XV Simpósio Brasileiro de Química Teórica
A-I
Energy of Indolic Intramolecular Rearrangement in the Biosynthesis of Violacein: A Theoretical Study
Samuel Anderson Alves de Sousa (PG), Raimundo Clécio Dantas Muniz Filho (PG) and Márcia Miguel Castro Ferreira (PQ)
Instituto de Química,
Universidade
Estadual de Campinas, CEP 13083-970 Campinas - SP.
e-mail: marcia@iqm.unicamp.br
Introduction and
goals
Violacein is a blue pigment produced by diverse bacteria
including Chromobacterium
violaceum,
a Gram-negative saprophite usually living in soil and water in tropical
and sub-tropical zones of the earth. This pigment exhibits antibiotic
activity against microorganisms that cause tuberculosis, Chagas disease
and leishmaniasis, and shows cytotoxic to tumor cells [1]. Biosynthesic
pathway of violacein production (Figure 1) consists of decarboxylative
fusion of two tryptophane units. That is why one of these molecules
undergoes intramolecular rearrangement known as 1,2-shift of the
indolic ring [2].
Figure 1. Route of biosynthesis of
violacein.
This rearrangement consist of movement of a substitutent to a neighboring atom in the same molecule via a reactive intermediate (carbocation, carbanion or free radical). The goal of this work is theoretical study of the energy of this mechanism in order to better understand the reaction, since such a study has not been yet reported in the literature.
Methods and results
Geometry optimization and vibrational frequency calculations were
performed using the DFT/B3LYP method and basis set
6-31G(d,p).
In general,calcuations have shown that the molecular rearrangement
contributes a little to free energy (1.96 kcal/mol), therefore, it is
not possible to make conclusion about the spontaneity of the process
when thermal energy is taken into account.
Momen & Hoshino [2] have reported dissociation of the C-C
bond between the indolic ring (R)
and side chain (F) of
tryptophane (see Figure 2 (2A)) as the first step in the molecular
rearrangement. Energy of pairs (R+,F-) e (R-,F+) was calculated and presented
in Table 1, with purpose to have insight into the most probable way of
this bond disruption.
Figure 2. The 1,2-shift of the
indolic ring.
According to results
showed in the table, bond dissociation is favored when the side chain (F) releases electron to the indolic
group (R). Stabilization of the positive
charge at F suggests a
rearrangment in which a more stable carbocation is formed, which is
then attacked by R- resulting in formation of
species 2B.
Table 1. Calculated energies
for species
probably involved in the rearrangement.
__________________________________
Pairs
Energy (Hartree)
__________________________________
R++
F-
-761.22
R-
+ F+-
-761.27
__________________________________
Conclusions
The obtained results indicate directions for future research of the
studied rearrangement. In the present moment, the study is continued by
search for intermediates and the most stable species involved in the
reaction.
Acknowledgement
Authors aknowledge CNPq and CAPES for supporting the research.
92