|
AN ATOMIC ORBITAL
IN DIFFERENT VIEWS
Authors : Maria
Eugência G. Porto
Márcia M. C. Ferreira
Departamento de
Físico-Química / Instituto de Química / Ramal 8413
The
main purpose of this work is to present the hydrogen atom by means
of graphical resources,
an area that has been recently developed rather
rapidly as a part
of computing.
Therefore,
a software called Mathematica, developed by Stephen Wolfram,
is used in this
work. The hydrogen atom is divided into radial and angular
parts, and then
it is presented by the total wavefunction.
I) The radial part of the hydrogen atom :
The radial part of the wavefunction describes only the electron-
nucleus distance.
R(n,l) = (r^l) exp[-zr/na] Laguerre Polynomials
II) The angular part of the hydrogen atom :
The eigenfunctions for the angular part of the hydrogen atom are
known as spherical
harmonics :
Y(l,m,theta,phi)
= [(2l+1)(l-m)!/4Pi(l+m)!]P(l,m).Cos[theta].Exp[i m phi]
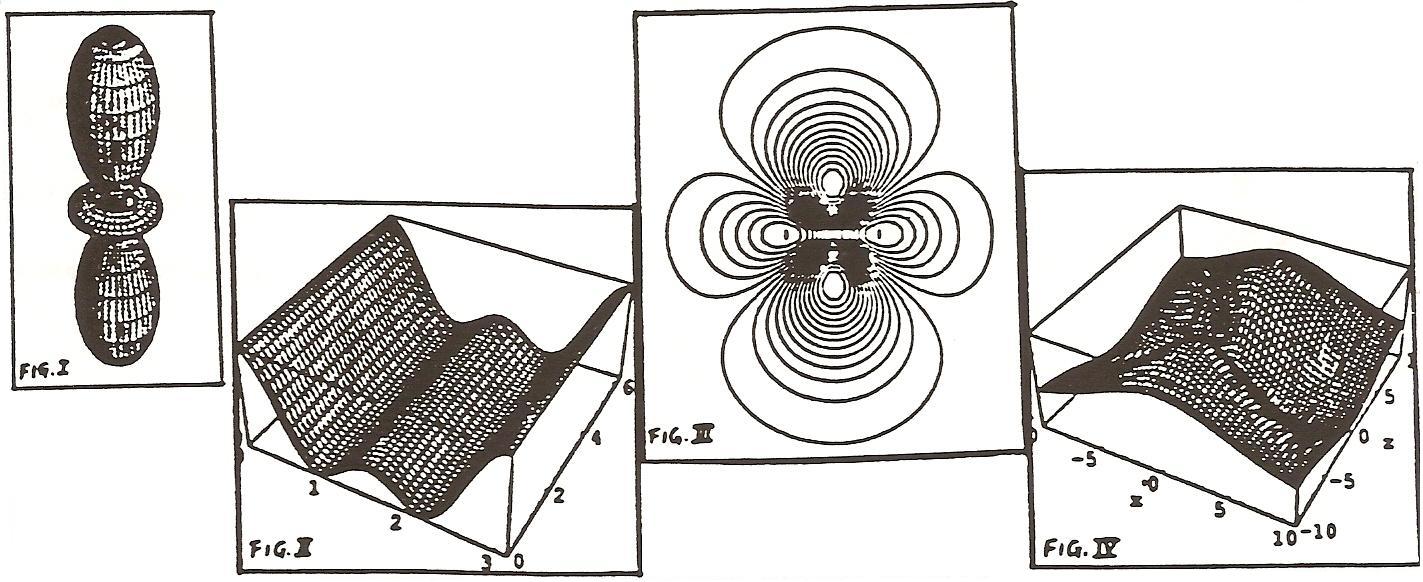
In Mathematica, the graphs of the squared spherical harmonic Y(2,0)
can be represented
in spherical polar coordinates (Fig. I), and in
Cartesian coordinates
(Fig. II).
III) The total wavefunction of the hydrogen atom :
The total wavefunction of the hydrogen atom can be defined as :
for m=0 -> Y(n,l,m) = R(n.l) . Y(l,m)
for m¹0
-> Y(n,l,m) = R(n.l) . [(-1) {Y(l,m) + Y(l,-m)}]
To represent functions of three variables, r, theta, and phi (or, x,
y, and z), four
dimensions are necessary. By fixing a variable to zero,
two types of graphs
are obtained with Mathematica for each orbital :
isoprobabilistic
contour curves or lines (Fig. III), and three-dimensi-
onal surfaces
(Fig. IV).
|
